Ezen az oldalon azt vizsgáljuk meg, hogyan lehet saját készítésű üzemanyag cellákat építeni. Különböző megoldások léteznek, ezeket tárgyaljuk a lenti sorokban.
![]()
Megvan a lehetőségűnk, hogy igazán jól használható üzemanyag cellát építsünk. Egyre több olyan Internetes áruház alakul, ahol az üzemanyag cellák házi megépítéséhez kínálnak anyagokat és vegyszereket. Lehet készen vásárolni akár protoncserélő membránt is.
Ilyen áruházak pl. a következők:
A protoncserélő membrán "lelke" a Nafion, mely perfluorozott polimer gyanta, szulfonsav-csoportokkal. Ionvezető tulajdonságokkal rendelkezik, azaz jól vezeti a hidrogén iont (protont), az elektronokkal szemben viszont szigetelőként viselkedik. A Nafion mindkét oldalán szénszövet található, melyek felületét nagyon vékony platina réteg borítja.
Ezeket a protoncserélő membránokat felhasználva 2 - 0,5 V-os feszültségen 0,5 - 2 A áramerősséget állíthatunk elő a bevezetett hidrogén gázok mennyiségének és a terhelő ellenállás értékének függvényében.
De figyeljük meg az árakat is! Egy wattos üzemanyag cella elkészítéséhez majdnem 100 dollárt kellene befektetnünk, nem is számolva még a postai költségeket. Amennyiben nagyobb teljesítményű üzemanyag cellát vásárolunk készen, úgy a wattonkénti fajlagos ár már "csak" 50 dollár körül mozog, de egy 1000 W-os üzemanyagcella ára így is eléri az egymillió forintot. Minél nagyobb a teljesítmény, annál alacsonyabb a kW-onkénti fajlagos ár, ezek az árak azonban még így is nagyon magasak!
Vajon lehet ennél sokkal olcsóbban is építeni üzemanyag cellát házilag? Bizony lehet, mégpedig az alkáli üzemanyag cellát (AFC). Ráadásul ennek az üzemanyag cella típusnak a legjobb a hatásfoka, olyan 70 % körül mozog!
Az alkáli üzemanyag cella az egyik legdinamikusabban fejlődő technológia, melyet a NASA az 1960-as évek közepe óta használ az Apolló és a Space Shuttle programokban. Az űrsiklókon üzemanyag cellák biztosítják az elektromos áramot a fedélzeti rendszerek számára.
Az alkáli üzemanyag cella elektrolitként vízben oldott KOH-t használ, melyet egy porózus stabilizáló mátrix foglal magában. A KOH koncentrációja az üzemanyag cella működési hőmérsékletének függvényében változhat. Ez a hőmérséklet 65 és 220 °C között változhat, bár az újabb fejlesztéseknél már 23 és 70 °C közötti értékekre is leeshet az üzemi hőmérséklet.
Az AFC felépítését a következő ábra mutatja.
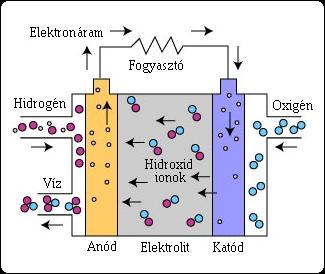
8. ábra. Az AFC felépítése
Az AFC-ben a töltéshordozó a hidroxid ion (OH-), mely a katódtól halad az anód felé, ahol a hidrogénnel reakcióba lépve vizet alkotnak és elektront szabadítanak fel. Az anódnál keletkezett vízmolekula a katód felé áramlik, hogy ott újból hidroxid ionná váljon. Az itt ismertetett reakció elektromos áramot és melléktermékként hőt termel.
Anód: 2 H2 + 4 OH- => 4 H2O + 4 e-
Katód: O2 + 2 H2O + 4 e- => 4 OH-
Egyesített reakció: 2 H2 + O2 => 2 H2O
Az AFC cellában az üzemi feszültség 300 mA/cm2 áramsűrűségnél kb. 0,8 V.
Az AFC egyik jellegzetessége, hogy nagyon érzékeny az üzemanyag vagy levegő CO2 tartalmára. A CO2 az elektrolittal reakcióba lépve azt gyors ütemben szennyezi, ennek hatására pedig jelentősen lecsökkenti az üzemanyag cella hatásfokát. Az AFC ezért csak zárt környezetben használható, mint pl. űrsiklókban vagy tenger alatt üzemelő eszközökben és csak tiszta hidrogén és tiszta oxigén lehet az üzemanyaga. A CO, H2O és CH4 molekulák, melyek amúgy teljesen ártalmatlanok, sőt még üzemanyagként is szolgálhatnak más típusú üzemanyag cellákban, az AFC számára károsak.
Az AFC-k nagy előnye viszont, hogy a többi üzemanyag cella típushoz képest nagyon olcsó a gyártási költségük, mivel a katalizátor szerepét számos, a platinához képest jóval olcsóbb anyag is betöltheti.
Az AFC-kről szóló információkat innét vettem.
Mielőtt egy komolyabb AFC megépítésén gondolkoznánk, nézzük meg, hogyan is lehet egy nagyon egyszerű AFC-t készíteni. A konyhaasztalodon is elkészíthetsz egy egyszerű üzemanyag cellát 10 perc alatt, hogy láthasd, hogyan lehet tiszta elektromos energiához jutni a hidrogén és oxigén egyesítése által.

1. ábra. A szükséges anyagok és eszközök
Az üzemanyag cella elkészítéséhez a következő dolgokra van szükségünk:
- Egy láb (305 mm) hosszú platinával bevont nikkel vezetékre, vagy tisztán platinából készült vezetékre. Mivel ez otthon nem egy gyakran előforduló anyag, ezért ezt egy katalógusból rendelhetjük meg.
- Egy kis méretű műanyag vagy fa pálcikára
- 9 V-os elem csatlakozójára
- 9 V-os elemre
- Cellux ragasztószalagra
- Voltmérőre
Első lépésként kettévágjuk a platinával bevont vezetéket, majd mindegyik darabot feltekerjük egy tekercs formájában. Ezek lesznek a mi üzemanyag cellánk elektródjai. Én a voltmérőm csatlakozó tüskéjére tekertem a vezetékeket, de használhatsz pl. egy szöget is erre a célra.

2. ábra. A voltmérő csatlakozó tüskéjére tekert vezeték
Ezt követően félbe vágjuk a 9 V-os elem csatlakozó vezetékét és a szabad végeit leblankoljuk, majd a platinával bevont vezetékekhez forrasztjuk. Ugyanide forrasztjuk a levágott csatlakozó vezeték végeket is, amik majd a voltmérőhöz fognak csatlakozni. Ezt mutatja a következő ábra.

3. ábra. Az "elektródák" és a hozzá csatlakozó vezetékek
Az elektródákat ezután egy fa pálcikához erősítjük, végül ezt a pálcikát biztonságosan egy vízzel teli pohár széléhez ragasztjuk. A pohár addig van vízzel töltve, hogy az elektródákat teljesen ellepje, de a csatlakozó vezetékek már a víz felszíne felett kell legyenek.
Ezután kapcsold a piros vezetéket a voltméter pozitív kapcsához, a feketét pedig a negatívhoz (vagyis a "test"-hez). A voltmérőn ekkor 0 V-ot lehet mérni, bár előfordulhat, hogy egy kis feszültség, kb. 0,01 V megjelenik.

4. ábra. A mérés kezdetekor a voltmérőn 0 V a feszültség
Az üzemanyag cellánk ezzel el is készült.
Az üzemanyag cella működtetéséhez arra van szükség, hogy hidrogén buborékok áramoljanak az egyik elektróda mentén és oxigén buborékok a másik elektróda mentén. Ezt nagyon egyszerűen elérhetjük.
Kapcsoljuk a 9 V-os elemet a csatlakozóra (tulajdonképpen elég, ha csak hozzáérintjük, mert csak pár másodpercig van erre szükségünk.)
Amikor az elemet hozzáérintettük a csatlakozóhoz, akkor az elektromos áram a vizet elkezdi hidrogénra és oxigénra bontani. Ez az elektrolízis. Láthatod, hogy amíg az elemet csatlakoztatjuk az elektródákhoz, addig azok mentén buborékok alakulnak ki.

5. ábra. Az elektrolízis folyamata
Most pedig vegyül el az elemet a csatlakozótól. Ha nem platinával bevont vezetéket használtunk volna, akkor a voltmérőn 0 V-ot kéne ismét látnunk, hiszen nincsen az elem csatlakoztatva.
Viszont a platina katalizátorként játszik szerepet, azaz a hidrogén és oxigén gázok újra egyesülését megkönnyíti.
![]()
Megjegyzés: A fenti sorok nem teljesen helytállóak, mivel a kísérleteink tanúsága szerint a platina nélkül is megfigyelhető ez a jelenség.
![]()
Az elektrolitikus reakció ekkor megfordul. Most ahelyett, hogy a cella elektródjaira áramot vezetnénk a víz szétbontásához, a hidrogén és oxigén gázok újból vízzé egyesülnek, miközben elektromos áram termelődik.

6. ábra. Az elektródákon mérhető feszültség az elem lekapcsolásának pillanatában
Az elem lekapcsolásának első pillanataiban az elektródák kapcsain egy kicsit több mint 2 V-ot mérhetünk a voltmérővel. Amint a buborékok feljutnak a víz felszínére, vagy ismét vízzé alakulnak, a feszültség esni kezd, először meredeken, majd egyre lassabban.

7. ábra. Az elektródákon mérhető feszültség az elem lekapcsolása után kb. egy perccel
Kb. egy perc múlva a feszültség sokkal lassabban csökken. Figyeljük meg, hogy a 9 V-os elem energiáját hidrogén és oxigén gázok formájában tároljuk. Természetesen a hidrogént és az oxigént másmilyen forrásból is az elektródákra juttathatnánk és így is elektromosságot tudnánk termelni.
A kísérletet innét fordítottam.
Egy másik weboldalon egy ehhez hasonló kísérlet leírása található, ott viszont még két rövid videófilmet is láthatunk.
1. videó. A platinával bevont elektródák mentén fejlődő gázok (0,24 MB, 0:13 perc)
2. videó. Az elektrolízis folyamata, majd az elem lekapcsolásakor beinduló energiatermelés és feszültségesés (0,28 MB, 0:13 perc)
A videókat innét töltöttem le.
A fentebb bemutatott egyszerű kísérlet természetesen csak a jelenség megismerésére jó. A kísérletben platinával bevont vezetékek képezték az elektródákat. Az AFC nagy előnye viszont, hogy nem kell a nagyon drága platinát használnunk katalizátornak. Ha viszont nem használunk platinát, akkor az üzemanyag cellánk előállításának ára drasztikusan lecsökkenhet olyan szintre, ami egy nagyobb teljesítményű üzemanyag cellát is könnyen elérhetővé tesz.
A platina történetéről érdekességképpen itt olvashatsz.
A jelenleg használt AFC üzemanyag cellák elektrolitja nem folyékony, hanem géles vagy szilárd halmazállapotú - pl. azbesztet itatnak át KOH oldattal. Az elektródák külső felülete mentén áramoltatják a hidrogén és oxigén gázokat. Mivel az elektródák porózus szerkezetűek, ezért az oxigén és a hidrogén gázok átjuthatnak az elektródák falán, miközben elektronleadással H+ ionná illetve elektronfelvétellel OH- ionná válnak.
A mi célunk az, hogy a lehető legegyszerűbben és legolcsóbban tudjuk elkészíteni az üzemanyag cellánkat. Vegyünk két saválló lemezt, ezek lesznek az elektródák, melyeket KOH oldatba, mint elektrolitba merítünk. Mivel ezek a lemezek nem porózus szerkezetűek, ezért a gázokat a lemezek egymás fele néző belső felülete mentén áramoltatjuk át.
Ahhoz, hogy a hidrogén és oxigén gázok ne keveredjenek el egymással, az elektrolit oldatba a két elektróda közé egy elválasztó hálót helyezünk, melyben a lyukak nem lehetnek 0,1 mm-nél nagyobbak, így a gázok nem tudnak rajta átjutni, az ionok viszont igen.
A gázokat alulról vezetjük az elektróda lemezekhez, s azok az oldat felhajtóerejének hatására felfelé áramolnak. Az anód mentén áramló hidrogén elektront ad le, a katód mentén áramló oxigén pedig elektront vesz fel, miközben a vízzel egyesülve hidroxid ionok keletkeznek.
Ahhoz, hogy a gázbevezető csövekbe ne folyjon be az elektrolit oldat, használjunk egyutas szelepeket. Az elektródák tetején megjelenő gázokat felfogjuk és egy-egy csövön keresztül visszavezetjük az elektródák aljához.
Ez a megoldás viszonylag egyszerűen megvalósítható, gyakorlatilag a meglévő elektrolizálónkat egy kis módosítással használhatjuk is erre a célra.
Amennyiben kedvet kaptál az üzemanyag cella megépítéséhez, arra kérlek, hogy küldd el nekünk az eredményeidet.
Kapcsolódó kísérletek:
- Elektrolízis Impulzusokkal 1 (lásd az 1. és a 2. kísérletet)
![]() Az
ÜC feszültsége
Az
ÜC feszültsége![]() Menü
Menü![]() Kísérletek
Kísérletek![]()
Utolsó frissítés dátuma: 2006 február 02.