Ezen az oldalon az üzemanyag cellák működési elvéről olvashatsz. Azonban mielőtt elkezdenénk tárgyalni, hogyan is épülnek fel az üzemanyag cellák, ismételjük át a redoxi reakciókról tanultakat, hiszen az üzemanyag cellákban is redoxi reakciók játszódnak le.
![]()
A redoxi reakciók elektronátmenettel járó reakciók, melyek során egyidejű elektron leadás és felvétel történik.
Az elektron leadást oxidációnak, az elektronfelvételt pedig redukciónak nevezzük. Az oxidáció során az oxidációs szám nő, a redukció során pedig csökken.
Nézzük meg a következő példákat:
2 H2 => 4 H+ + 4 e- oxidáció
O2 + 4 H+ + 4 e- => 2 H2O redukció
Az oxidáció és redukció mindig egyidejűleg játszódik le és az elektronátmenet során megváltozik a részecskék töltése.
Az oxidációs szám az adott anyagot felépítő atomok töltése. Gondolatban a nagyobb elektronegativitású atomhoz rendeljük a közös elektronpárt, s az így keletkezett ion töltésszámával egyezik meg az oxidációs szám.
Az oxigén oxidációs száma az oxidokban (O2-): -2, a hidrogén oxidációs száma pedig (H+): +1. A molekulát felépítő atomok oxidációs számának algebrai összege zérus.
Ha az oxidációt és redukciót térben szétválasztjuk, akkor a kémiai reakció energiatermelésre használható!
A galvánelem és az üzemanyag cella olyan berendezések, melyek a kémiai energiát elektromos energiává alakítják át. Bennük önként végbemenő redoxi reakciók termelik az elektromos energiát.
A redoxi reakciókról az információkat innét vettem.
Az üzemanyag cella a következő részekből áll:
- Két elektródából (anódból és katódból)
- Katalizátorból, mely a két elektróda egymás felé néző oldalán található
- Elektrolitból (membránból), mely lehet szilárd vagy folyékony halmazállapotú
A következő ábrán az egyik legelterjedtebb, úgynevezett protoncserélő membrános üzemanyag cella elvi rajza látható.
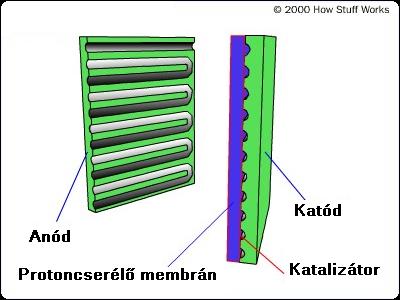
1. ábra. A protoncserélő membrános üzemanyag cella elvi rajza
A működési elv a következő: Az anódra adott nyomáson vezetett hidrogén molekulákat a platinából készült katalizátor szétválasztja hidrogén atomokra, majd az atomok elektronjait az anódra vezetve a H+ ionok a membránon átjutnak a katódhoz. A hidrogén ion egy pozitív töltésű protonból áll. A membránt ezért nevezik protoncserélőnek, mivel csak a hidrogén iont, azaz a protont engedi át, míg a negatív töltésű elektront nem. Az elektronok egy külső fogyasztón tudnak csak átjutni a katódba, miközben hasznos munkát végeznek.
A katódra vezetett oxigén molekulák a katalizátor segítségével szintén lebomlanak oxigén atomokra, melyek az anódból - valamilyen fogyasztón keresztül - átáramló elektronokkal és a membránon átjutott hidrogén ionokkal egyesülve vizet alkotnak.
Ezt a folyamatot a következőképpen írhatjuk le:
Anód: 2 H2 => 4 H+ + 4 e-
Katód: O2 + 4 H+ + 4 e- => 2 H2O
Egyesített reakció: 2 H2 + O2 => 2 H2O
A reakció során az egy cellán keletkező feszültség értéke kb. 0,7 V, a DC áramerősség pedig a másodpercenként átáramlott hidrogén és oxigéngázok mennyiségének a függvénye. Ha nagyobb feszültséget szeretnénk elérni, akkor több cellát kell sorba kapcsolnunk.
A következő ábrán egy egyszerű animációt láthatunk. Az indításhoz nyomd le a "Close" gombot, majd az "Activate"-t, végül pedig a "Continue" gombot.
2. ábra. Az üzemanyagcella működését bemutató animáció
A működési elvet bemutató ábrát és animációt innét vettem.
Az üzemanyag celláknak több típusa létezik, melyeket az elektrolit (membrán) anyaga szerint csoportosíthatunk. A különböző elektrolitok különböző tulajdonságokkal ruházzák fel az üzemanyagcellát és a reakciók is különböző hőmérsékleten játszódnak le. Ennek megfelelően a felhasználási területük is változik az elektrolit függvényében.
A következő táblázat (melyet innét vettem) az egyes üzemanyag cellákat hasonlítja össze.
|
Típusa
|
Elektrolit
|
Működési hőmérséklet
|
Elektromos hatásfok
|
Üzemanyag
|
|
AFC |
30 % KOH oldat, gél | 80 °C | elméleti: 70% gyakorlati: 62% |
- tiszta H2 - O2 |
|
PEMFC (proton-áteresztő) |
protonáteresztő membrán | 80 °C | elméleti: 68% gyakorlati: 50% |
- tiszta H2 - O2 - levegő |
|
DMFC (direkt metanol) |
protonáteresztő membrán | 80 - 130 °C | elméleti: 30% gyakorlati: 26% |
- metanol, - O2 - levegő |
|
PAFC (foszfor-savas) |
tömény foszforsav | 200 °C | elméleti: 65% gyakorlati: 60% |
- tiszta H2 - O2 - levegő |
|
MCFC (alkáli-karbonátsó)
|
lítium-karbonát, kálium-karbonát |
650 °C | elméleti: 65% gyakorlati: 62% |
- H2 - földgáz - széngáz - biogáz - levegő - O2 |
|
SOFC (oxid-kerámia) |
yttrium-cirkon oxidkerámia | 800 - 1000 °C | elméleti: 65% gyakorlati: 62% |
- H2 - földgáz - széngáz - biogáz - levegő - O2 |
1. táblázat. Az üzemanyag cellák összehasonlítása
Mint látjuk, az üzemanyag cellák katódjára oxigént vezetünk, mely nagy mennyiségben található a levegőben, így tulajdonképpen nem tiszta oxigént vezetnek a katódra, hanem levegőt (kivételt képez az AFC).
Az anódra vezetett hidrogén már nem áll ilyen szabadon a rendelkezésünkre, azt elő kell állítani pl. a víz elektrolízise segítségével vagy valamilyen gázból, pl földgázból kell azt kinyerni speciális készülék, az un. reformer segítségével.
Az elektródákon mérhető feszültségkülönbség nem nagy, 0,7 V körül van, ezért pl. 12 V-os feszültség eléréséhez 17 db cellát kell sorba kapcsolni. Ha a lakásunk, házunk villamos fogyasztóit szeretnénk táplálni az üzemanyag cellával, akkor még egy invertert is közbe kell iktatnunk, ami a - mondjuk - 12 V egyenfeszültséget átalakítja 220 V 50 Hz-es váltakozó feszültséggé.
A cellákban lejátszódó redoxi reakciónak azonban van egy mellékterméke is, mégpedig a hő. Az 1. táblázat harmadik oszlopában van feltűntetve az egyes elektrolitoknál felszabaduló hő. Ebből az is következik, hogy ha a ház elektromos fogyasztóinak a táplálását üzemanyag cellákkal oldjuk meg, akkor a felszabaduló hőt pl. vízmelegítésre, esetleg fűtésre is hasznosíthatjuk.
![]() Az
ÜC története
Az
ÜC története![]() Menü
Menü![]() Az
ÜC feszültsége
Az
ÜC feszültsége![]()
Utolsó frissítés dátuma: 2006 január 23.